Immunseneszenz ist eine fortschreitende und degenerative Veränderung des Immunsystems, die beim Älterwerden auftritt. Diese Veränderungen können Folgendes bewirken:
- Eine verminderte Immunfunktion, wodurch ältere Menschen anfälliger für Infektionskrankheiten werden oder schwerere Formen davon entwickeln.
- Chronische Entzündungen: Diese anhaltenden Entzündungen können zur Entstehung altersbedingter Krankheiten wie Herz-Kreislauf-Erkrankungen, Typ-2-Diabetes und Demenz beitragen.
- Eine Veränderung der Zusammensetzung der Immunzellen: mit einer verminderten Anzahl von naiven (nicht spezialisierten) T-Lymphozyten ab und die Zahl der Gedächtnis-T-Lymphozyten (spezialisiert) zu. Dies kann Fähigkeit des Immunsystems, neue Krankheitserreger zu erkennen, einschränken.
- Verminderte Reaktion auf Impfungen: Ältere Menschen können nach einer Impfung eine weniger robuste Immunantwort haben − ebenso wie immungeschwächte Menschen − was manchmal höhere Dosen oder zusätzliche Auffrischungsimpfungen für einen ausreichenden Schutz erforderlich macht.
Auch das Immunsystem wird älter
Diese Veränderungen sind unter anderem darauf zurückzuführen, dass die im Knochenmark lokalisierten Blutstammzellen mit zunehmendem Alter weniger produktiv sind. Insbesondere stellen sie weniger weisse Blutkörperchen her, die ein wichtiger Bestandteil des Immunsystems sind. So wurde zum Beispiel der Shingrix®-Impfstoff gegen Gürtelrose mit speziellen Adjuvantien formuliert, welche die Immunantwort verstärken und verlängern. Dieser Impfstoff ist für die am stärksten gefährdeten Personen geeignet, d. h. Personen ab 65 Jahren oder Personen, die eine Immunsuppression erhalten. Andere derzeit geprüfte Optionen bestehen darin, diesen Personen höhere Impfstoffdosen (dies ist z. B. beim Impfstoff Efluelda® gegen die saisonale Grippe der Fall), oder häufigere Auffrischungsimpfungen zu verabreichen.
Krankheit und Therapien mindern Abwehrkräfte
Neben dem Alter können aber auch verschiedene Krankheiten sowie deren Therapien zu einer Schwächung des Immunsystems führen. Beispielsweise müssen Menschen nach einer Organtransplantation immunsupprimierende Medikamente einnehmen, die verhindern, dass der Körper das transplantierte Organ als fremd erkennt und abstösst. Dies erhöht die Anfälligkeit für Infektionskrankheiten. Deshalb sollten eventuell fehlende Impfdosen möglichst vor der Durchführung einer Transplantation nachgeholt werden.
Ebenfalls unterdrückt ist das Immunsystem nach einer Stammzelltransplantation, etwa bei Leukämie. Hierbei werden zunächst die eigenen Immunzellen abgetötet und durch Stammzellen ersetzt. Es können mehrere Monate vergehen, bis sich aus den transplantierten Zellen ein neues und effektives Abwehrsystem entwickelt. Zudem geht dabei der aus vorherigen Impfungen erworbene Schutz vollständig verloren und muss nach und nach wieder aufgebaut werden.
Auch viele chronische Krankheiten sowie die dafür benötigten Medikamente haben einen negativen Einfluss auf das Immunsystem. So sind Menschen mit Multipler Sklerose, entzündlichen rheumatischen Erkrankungen, Autoimmunerkrankungen oder Darmerkrankungen anfälliger für Grippe, Hepatitis und das Humane Papilloma-Virus. Die Therapie dieser Krankheiten mit immunsuppressiven oder immunmodulierenden Medikamenten wie beispielsweise Kortikosteroiden kann diesen Effekt noch verstärken. Auch Krebserkrankungen und viele der Therapien dagegen führen zu einer Schwächung der Immunreaktion.
Für immunsupprimierte Menschen haben das BAG und die Eidgenössische Kommission für Impffragen (EKIF) Richtlinien und Empfehlungen entwickelt, die den bestmöglichen Impfschutz mit dem geringsten Risiko gewährleisten sollen. Von der Verabreichung von Lebendimpfstoffen wird dieser Bevölkerungsgruppe generell abgeraten, da dies zu einer "Impfkrankheit" führen könnte. Nicht zuletzt können auch Familienangehörige und enge Kontaktpersonen einen Beitrag leisten: Wenn sie sich impfen lassen, schützen sie immungeschwächte Personen, indem sie das Risiko für eine Ansteckung einschränken.
Referenzen (Auswahl):
Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immunity & Ageing. 2019;16(1):25. doi:10.1186/s12979-019-0164-9
Doherty M, Schmidt-Ott R, Santos JI, et al. Vaccination of special populations: Protecting the vulnerable. Vaccine. 2016;34(52):6681-6690. doi:10.1016/j.vaccine.2016.11.015
Allen, Toapanta, Chen, Tennant. Understanding immunosenescence and its impact on vaccination of older adults. Vaccine. 2020;38(52): 8264-8272. doi.org/10.1016/j.vaccine.2020.11.002
Ciabattini, Annalisa et al. “Vaccination in the elderly: The challenge of immune changes with aging.” Seminars in immunology vol. 40 (2018): 83-94. doi:10.1016/j.smim.2018.10.010
Was sind Adjuvantien und wozu braucht es sie ?
Ein Adjuvans ist ein wichtiger Bestandteil vieler inaktivierter Impfstoffe − zu verstärken und verlängern die Reaktion des Immunsystems. Die Bezeichnung Adjuvans leitet sich vom lateinischen Verb adjuvare ab, das «helfen» bedeutet.
Die allerersten Impfstoffe, etwa gegen die Pocken, benötigten keine Adjuvantien: Sie bestanden aus vollständigen − wenn auch abgeschwächten − Viren, die ohne Hilfe eine starke Immunantwort im Körper auslösten. Heutzutage enthalten viele Impfstoffe nur noch Bruchstücke der Krankheitserreger. Dies verhindert zwar starke Nebenwirkungen, hat aber den Nachteil, dass das Immunsystem schwächer reagiert.
Nur eine Handvoll Adjuvantien bekannt
Eine Lösung für dieses Problem entdeckte der britische Immunologe Alexander Glenny in den 1920er Jahren durch einen Zufall: Er stellte fest, dass winzige Mengen eines unlöslichen Aluminiumsalzes im Impfstoff die Immunantwort verstärkten. Diese Salze (Aluminiumhydroxide und Aluminiumphosphate) − umgangssprachlich auch als "Alum" bezeichnet − waren die ersten Adjuvantien und sind bis heute ein Bestandteil vieler Impfstoffe (siehe Tabelle unten).
Früher stand das in den Impfstoffen enthaltene Aluminium im Verdacht, Krankheiten wie Brustkrebs oder Allergien auszulösen. Ein solcher Zusammenhang gilt mittlerweile als ausgeschlossen, unter anderem weil die enthaltenen Mengen äusserst gering sind (siehe auch Aluminium in Impfstoffen). Allerdings können nach einer Impfung mit Vakzinen, die Alum enthalten, vorübergehend Nebenwirkungen wie Rötungen oder Schwellungen an der Einstichstelle auftreten. Dies ist ein Zeichen dafür, dass das Immunsystem aktiviert ist.
Über 70 Jahre lang waren Aluminium-Salze die einzigen bekannten Adjuvantien und sie kamen milliardenfach zum Einsatz. Erst in den letzten Jahrzehnten wurde eine Handvoll weiterer Substanzen entdeckt und für den Gebrauch im Menschen zugelassen. Dazu gehören beispielsweise Emulsionen aus Wasser und Öl, die unter dem Namen «MF59» in den saisonalen Grippeimpfstoffen enthalten sind.
Die neuesten Adjuvantien sind die Saponine − aus der Rinde des chilenischen Seifenrindenbaums gewonnene Substanzen. Diese sind Bestandteil der Impfstoffe gegen Gürtelrose (Shingrix®) und RSV (Arexvy®), die in der Schweiz empfohlen werden. Um ihre Wirkung zu optimieren, sind auch Kombinationen von verschiedenen Adjuvantien möglich.
Schwierige Suche nach neuen Adjuvantien
Die Suche nach neuen Adjuvantien ist nicht einfach: Denn sie sollen nicht nur das Immunsystem aktivieren, sondern dürfen auch nur wenige Nebenwirkungen haben und müssen im Körper wieder abgebaut werden. Auch eine günstige Herstellung und lange Haltbarkeit sind wichtige Kriterien.
Ein weiterer Hinderungsgrund ist, dass die genaue Wirkungsweise von Adjuvantien immer noch nicht vollständig geklärt ist. Lange Zeit wurde beispielsweise vermutet, dass Alum eine Art Depot-Effekt hat und den Impfstoff langsam freisetzt, so dass die Immunantwort länger ausfällt. Mittlerweile ist klar, dass die Aluminiumsalze noch viel mehr bewirken: Über verschiedene Signalwege alarmieren sie das Immunsystem und locken bestimmte Immunzellen an. Diese stossen dann auf die Bruchstücke der Krankheitserreger und veranlassen die Ausbildung einer spezifischen Immunität. Die Emulsionen oder Saponine scheinen ähnliche Mechanismen zu aktivieren.
Die Forschung befasst sich weiterhin mit neuen Arten von Adjuvantien, um die Wirksamkeit von inaktivierten Impfstoffen zu erhöhen oder um speziell auf die Bedürfnisse bestimmter Bevölkerungsgruppen wie Kinder oder ältere Menschen einzugehen. Übrigens benötigen nicht alle Impfstoffe ein Adjuvans: Kombinationsimpfstoffe gegen Masern, Mumps und Röteln (MMR) enthalten vollständige, abgeschwächte Krankheitserreger, die keine zusätzlichen Substanzen brauchen. Und im Fall der Boten-RNA-Impfstoffe gegen SARS-CoV-2 wirken die mit RNA beladenen Lipidnanopartikel selbst als Adjuvans.
Beispiele von in der Schweiz zugelassenen Impfstoffen und darin enthaltenen Adjuvantien
|
Impfstoff |
Krankheit |
Adjuvans |
|
Priorix |
MMR (Masern, Mumps, Röteln) |
- |
|
Boostrix |
DTP (Diphtherie, Tetanus, Keuchhusten) |
Aluminiumsalze |
|
Prevenar |
Pneumokokken/ Lungenentzündung |
Aluminiumsalze |
|
Gardasil |
HPV (Humanes Papillomavirus) |
Aluminiumsalze |
|
Twinrix |
Hepatitis A/Hepatitis B |
Aluminiumsalze |
|
Encepur |
FSME (Virale Hirnhautentzündung) |
Aluminiumsalze |
|
Fluad |
Saisonale Grippe |
MF59 |
|
SHINGRIX |
Varicella zoster (Gürtelrose) |
AS01B |
|
Novavax |
SARS-CoV2 |
Matrix M-1 |
|
Comirnaty |
SARS-CoV2 |
- |
|
Spikevax |
SARS-CoV2 |
- |
Quellen:
C. Reyes et al.: Adjuvants approved for human use: What do we know and what do we need to know for designing good adjuvants? European Journal of Pharmacology (2023)
https://doi.org/10.1016/j.ejphar.2023.175632
B. Pulendran et al.: Emerging concepts in the science of vaccine adjuvants. Nature Review Drug Discovery (2021).
https://doi.org/10.1038/s41573-021-00163-y
J.-D. Masson et al.: Advances on the early cellular events occurring upon exposure of human macrophages to aluminum oxyhydroxide adjuvant. Scientific Reports (2023)
https://doi.org/10.1038/s41598-023-30336-1
K. Kobiyama et al.: Making innate sense of mRNA vaccine adjuvanticity. Nature Immunology (2022)
https://doi.org/10.1038/s41590-022-01168-4
Wie wird ein Impfstoff entwickelt?
Ein Impfstoff dient dazu, das Immunsystem zu trainieren, damit es einen Krankheitserreger abwehren kann. Viele schwere oder sogar tödliche Krankheiten werden von Mikroorganismen verursacht, also von Viren, Bakterien oder sogar Parasiten (etwa im Falle von Malaria). Schon wenige Stunden nach einer Impfung werden die spezialisierten weissen Blutkörperchen des Immunsystems – die so genannten B-Zellen und T-Zellen – aktiviert. Und nach etwa 15 Tagen setzen die B-Zellen im Blut Antikörper frei. Sie sind in der Lage, sich an den vom Impfstoff imitierten Erreger zu binden. Dadurch verhindern die Antikörper, dass der Erreger in menschliche Zellen eindringt. Die T-Zellen (oder «Killerzellen») andererseits eliminieren den Erreger. So verhindern sie den Ausbruch einer Krankheit und begrenzen das Risiko von Komplikationen.
Damit das Immunsystem B- und T-Zellen produzieren kann, die gegen einen spezifischen Mikroorganismus wirksam sind, muss es lernen, bestimmte Eigenschaften des Mikroorganismus zu erkennen: Oft handelt es sich um spezifische Proteine auf der dessen Oberfläche. Diese charakteristischen Elemente sind auch in einem Impfstoff enthalten, der sie dem Immunsystem auf verschiedene Weise präsentieren kann:
- Es gibt Impfstoffe, die den gesamten Mikroorganismus – allerdings in abgeschwächter Form – enthalten. Dabei wird der Keim verändert, um ihn weniger aggressiv zu machen, beispielsweise indem seine Fähigkeit, sich zu vermehren, verringert wird. Solche abgeschwächten Lebendimpfstoffe wirken am besten, aber erfordern auch die meisten Vorsichtsmassnahmen. Abgeschwächte Lebendimpfstoffe lösen eine stärkere und länger anhaltende Immunantwort aus, deshalb ist nach einer oder zwei Dosen keine Auffrischimpfung mehr nötig. Ihr Hauptnachteil besteht darin, dass sie (mit einigen Ausnahmen) nicht an Menschen abgegeben werden können, deren Immunsystem durch bestimmte Krankheiten oder medizinische Behandlungen geschwächt ist.
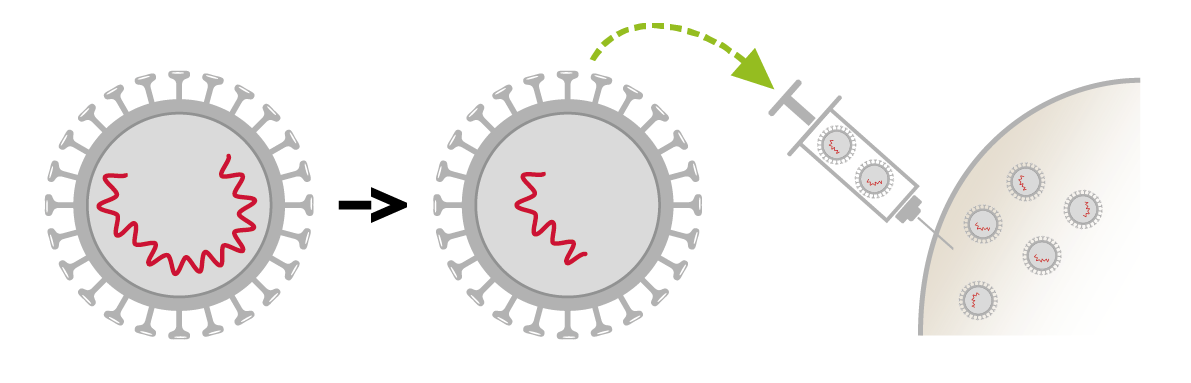
Aktuelle abgeschwächte Lebendimpfstoffe (MMR: Masern-Mumps-Röteln, Windpocken, Gelbfieber, Rotavirus).
- Andere Impfstoffe enthalten den gesamten Mikroorganismus in inaktivierter Form. Der Erreger wird abgetötet und ist dadurch völlig unfähig, sich zu vermehren und Krankheiten zu verursachen. Inaktivierte Impfstoffe sind im Allgemeinen weniger wirksam als abgeschwächte Lebendimpfstoffe und erfordern oft mehrere Dosen oder Auffrischdosen. Ihr Hauptvorteil ist, dass sie nur sehr wenige Nebenwirkungen haben und auch Menschen mit geschwächtem Immunsystem verabreicht werden können.
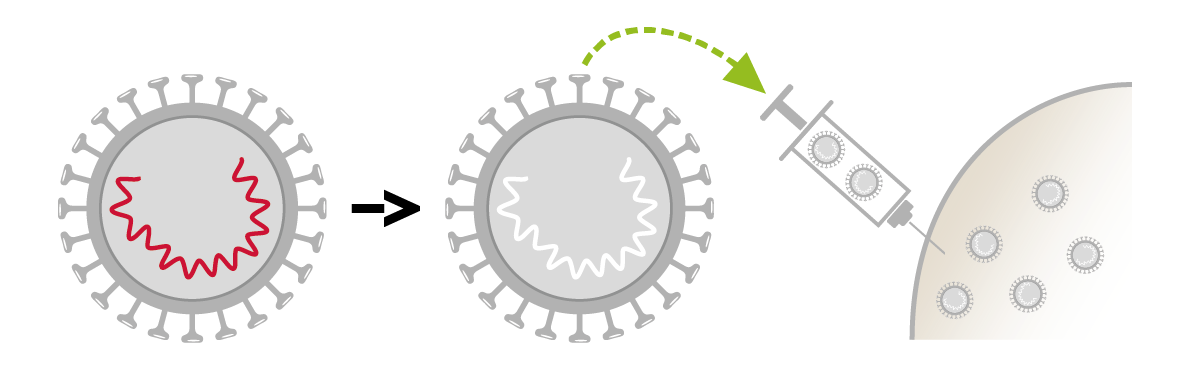
Aktuelle inaktivierte Impfstoffe (Polio, Hepatitis A, FSME, Meningokokken)
- Es gibt auch gereinigte Impfstoffe, die nur Fragmente eines Mikroorganismus enthalten. Solche Impfstoffe enthalten nur die Teile des Erregers, die nötig sind, damit das Immunsystem den Erreger erkennen kann. Die gereinigten Impfstoffe haben den Vorteil, dass sie das Immunsystem sehr gezielt stimulieren. Ihre Verträglichkeit ist daher ausgezeichnet, allerdings sind oft Auffrischimpfungen erforderlich. Swissmedic Erklärvideos zu Protein-basierten (gereinigten) Impfstoffen. .
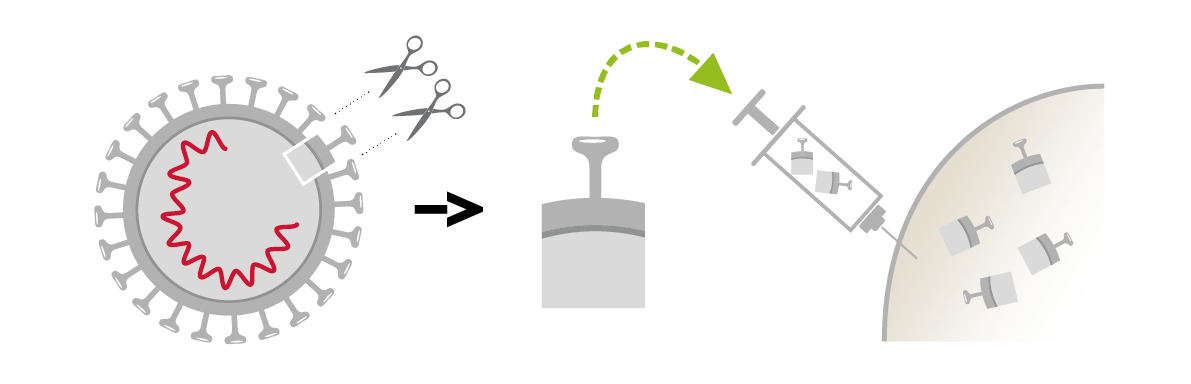
Gereinigte Impfstoffe (Diphtherie, Tetanus, Keuchhusten, Hepatitis B, HPV, Grippe, Gürtelrose, etc.)
- Eine weitere Klasse von Impfstoffen enthält nur die komplexen Zuckermoleküle (Polysaccharide), die sich in der Zellwand von Bakterien befinden. Damit diese Zuckermoleküle vom Immunsystem besser erkannt werden können, werden sie an ein Transportprotein gebunden (oder im Fachjargon: konjugiert). Deshalb heissen sie konjugierte Impfstoffe. Meist sind mehrere Injektionen notwendig, um eine Immunität zu erlangen, die manchmal nur wenige Jahre anhält.
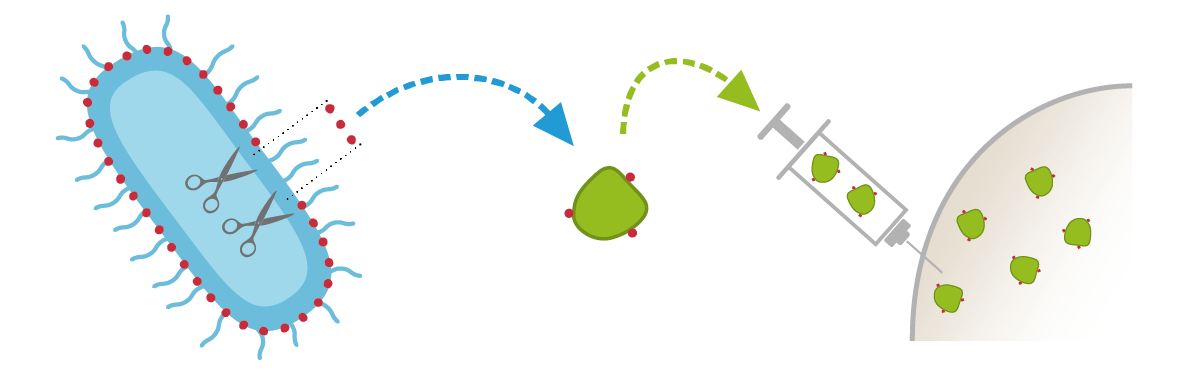
Konjugatimpfstoffe (Hib, Pneumokokken)
- Durch direkte Injektion eines Fragments des genetischen Materials des Mikroorganismus (Boten-RNA / mRNA), eingehüllt in Lipid-Nanopartikel, die aus verschiedenen Lipiden bestehen. Die Boten-RNA-Impfstofftechnologie ist seit etwa zehn Jahren bekannt, aber trotz ihrer Attraktivität (Einfachheit des Konzepts, schnelle Entwicklung und einfache Herstellung) konnte sie nicht von den notwendigen Investitionen profitieren vor der Mobilmachung, die auf die COVID-19-Pandemie folgte.
Vergleich zwischen einer natürlichen Coronavirus-Infektion und der Impfung mit Boten-RNA (vereinfachte Darstellung)
A. Natürliche Infektion
1. Ein SARS-CoV-2-Coronavirus dringt in den menschlichen Körper ein und heftet sich dann mit seinen nagelförmigen Oberflächenproteinen (auf Englisch heisst dieses Protein Spike) an eine Zelle an.
2. Das Virus wird von der Zelle aufgenommen und gibt seine RNA (genetischer Code, der alle Informationen enthält, die zur Herstellung des Virus benötigt werden) in der Zelle frei.
3. Die menschliche Zelle verwendet ihre eigenen Werkzeuge, um die virale RNA abzulesen und stellt alle Teile des Virus (verschiedene Arten von Proteinen + virale RNA) ungewollt selbst her.
4. Neue Viren können sich selbst zusammensetzen und werden dann in den menschlichen Körper freigesetzt, um die Infektion fortzusetzen.
Um die Vermehrung des Virus zu stoppen, braucht es mehrere Tage, bis das Immunsystem des Körpers reagiert und schliesslich Antikörper produziert.
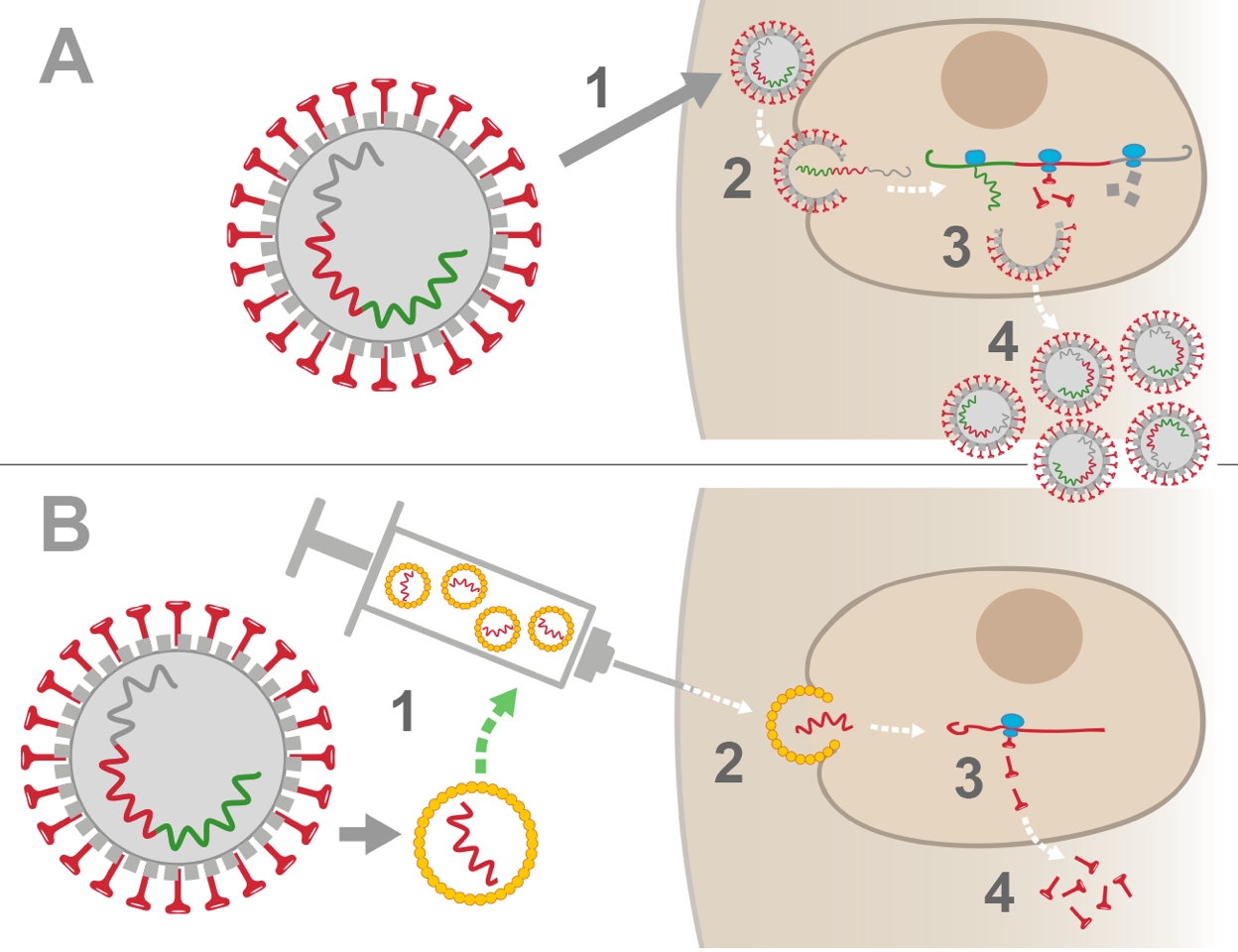
B. Impfung mit viraler Boten-RNA
1. Im Labor werden Boten-RNAs hergestellt, die nur für das Spike-Protein des Coronavirus kodieren. Die Boten-RNAs werden in kleine Fettbläschen verpackt.
2. Bei der Impfung werden die Fettbläschen in den Armmuskel injiziert und dann von menschlichen Muskelzellen aufgenommen: Die Boten-RNA werden freigesetzt.
3. Die menschliche Zelle verwendet ihre eigenen Werkzeuge, um die Boten-RNA abzulesen und nur Spike-Proteine herzustellen. Alleine sind diese Proteine nicht gefährlich für den Organismus.
4. Die Zelle setzt die viralen Spike-Proteine in den Körper frei - dies alarmiert das Immunsystem und ermöglicht es dem Körper, Antikörper gegen das Spike-Protein zu produzieren.
Wenn ein Coronavirus 2-3 Wochen nach der Impfung in den Körper eindringt, wird es vom Immunsystem schnell erkannt und neutralisiert, insbesondere mit Hilfe von Antikörpern gegen das Spike-Protein.
6. «Vektor»-Impfstoffe: Genetisches Material des Erregers wird in ein Virus oder Bakterium eingebracht, das beim Menschen keine Krankheiten verursacht. Diese so genannten «Vektoren» vermehren sich nur begrenzt im menschlichen Körper, so dass sie keine Infektion verursachen, aber dennoch die Immunantwort stimulieren. Bei diesen Impfstoffen handelt es sich um eine neue Technik, die sich allerdings zur Impfung gegen die Ebola-Krankheit und gegen einige Krebsarten schon bewährt hat. Bei den auf einem Adenovirus basierenden viralen Vektorimpfstoffen (Covid-19 Impfstoffe von Astra Zeneca/Oxford Universität und von Janssen/Johnson&Johnson) wird der genetische Code der Adenoviren so modifiziert (verstümmelte DNA), dass sich das Adenovirus im menschlichen Körper nicht vermehren kann. Es ist daher biologisch ausgeschlossen, dass das modifizierte Adenovirus eine Infektion verursachen kann. Die DNA dieser als Vektoren verwendeten Adenoviren kann in Zellkerne eindringen, ihr Einbau in die DNA menschlicher Zellen wird jedoch durch Modifikation der Enden der DNA-Stränge verhindert. Die DNA dieser Adenoviren wird im Zellkern in Boten-RNA transkribiert und dann ins Zytoplasma geschleust, wo sie in Proteine übersetzt wird.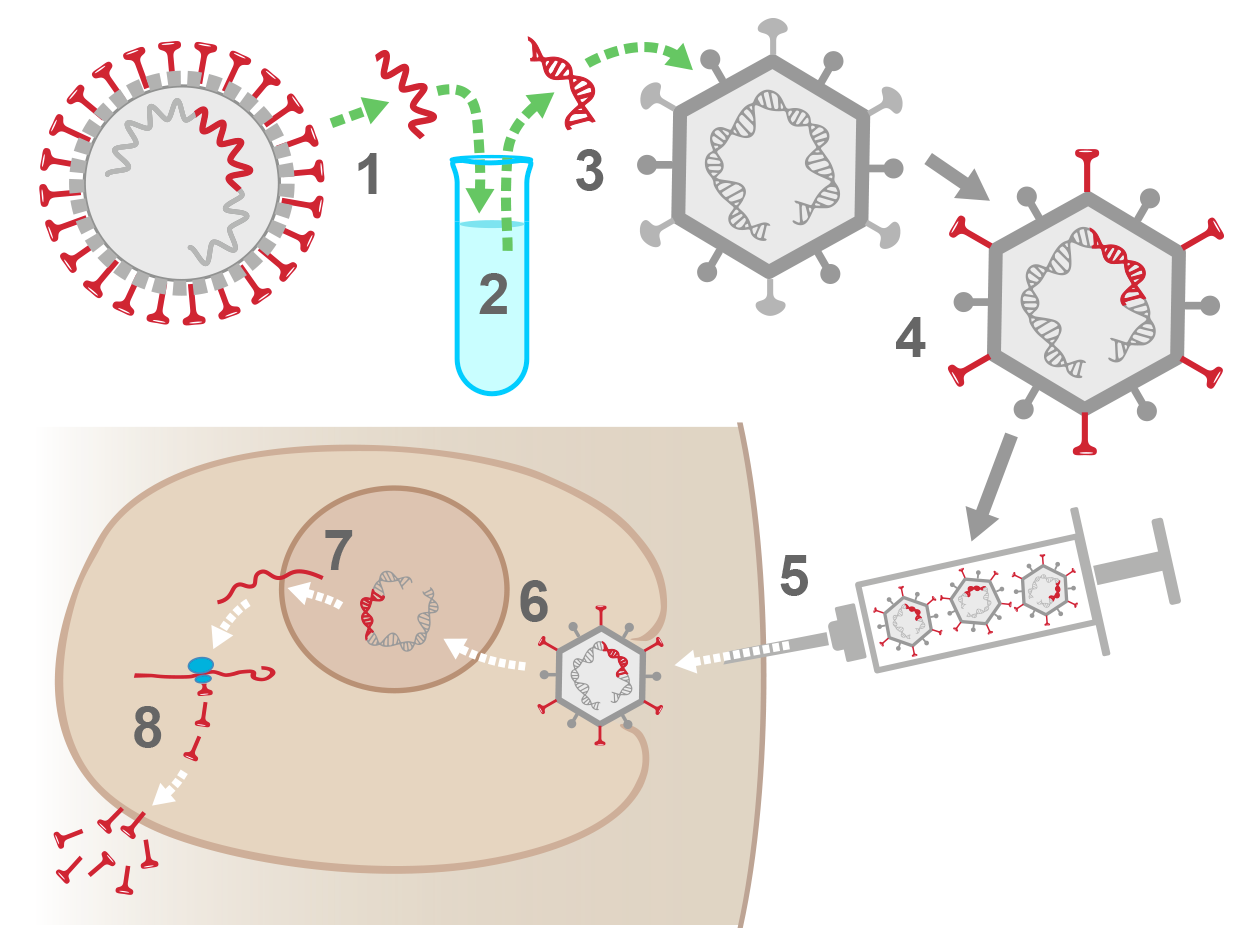
1. Im Labor wird die RNA-Sequenz des Coronavirus isoliert, welche die Information zur Herstellung seines Oberflächenproteins Spike (in rot) enthält.
2. Die RNA-Sequenz für Spike wird in eine DNA-Sequenz für Spike umgewandelt.
3. Die DNA -Sequenz für Spike wird in das Chromosom eines Adenovirus eingefügt.
4. Das modifizierte Adenovirus trägt das Oberflächenprotein Spike auf seiner Oberfläche, ist aber nicht in der Lage, sich zu vermehren.
5. Impfung: Modifizierte Adenoviren werden in den Arm einer Person injiziert.
6. Das modifizierte Adenovirus dringt in eine menschliche Zelle ein und überführt seine DNA in den Zellkern. Die Impfstoff-DNA ist modifiziert, damit sie nicht in das Genom integriert wird.
7. Im Zellkern wird die DNA -Sequenz für Spike in Boten-RNAs transkribiert, die dann den Zellkern verlassen.
8. Die Werkzeuge der menschlichen Zelle lesen die Boten-RNAs, stellen Spike-Proteine her und geben sie in den Körper ab - dadurch wird das Immunsystem alarmiert und der Körper kann Antikörper gegen das Spike-Protein produzieren.
Dringt ein Coronavirus 2-3 Wochen nach der Impfung in den Körper ein, kann das Immunsystem es schnell erkennen und neutralisieren, vor allem mit Hilfe von Antikörpern gegen das Spike-Protein.
Swissmedic Erklärvideos zu Vektor-Impfstoffen.
Welche Schritte müssen Impfstoffkandidaten durchlaufen, bevor sie eingesetzt werden können?
Ein Impfstoffkandidat muss mehrere Entwicklungsstadien durchlaufen.
Präklinische Versuche werden in der Regel zuerst an Nagetieren und in einem fortgeschrittenen Stadium an Affen durchgeführt. Dies ist ein wesentlicher Schritt, um die besten Impfstoffkandidaten auszuwählen und um zu vermeiden, dass Menschen Impfstoffe verabreicht werden, die nicht oder zu stark wirken. Auch wenn die präklinischen Versuche ausgezeichnete Ergebnisse liefern, kann man die Resultate nicht direkt auf den Menschen übertragen.
Klinische Studien (am Menschen) werden in vier Phasen durchgeführt:
- An Phase-I-Studien nehmen in der Regel einige Dutzend Freiwillige teil. Die Versuche sind darauf ausgelegt, die beste Dosis des experimentellen Impfstoffs zu bestimmen. Dabei werden die von den Probanden produzierten Antikörper gemessen. In diesen Versuchen können auch schon häufig auftretende mögliche Nebenwirkungen zu Tage treten.
- Phase-II-Studien erweitern die Wissensbasis. Normalerweise nehmen mehrere hundert oder tausend Freiwillige in verschiedenen klinischen Zentren daran teil. Die Probanden werden mehrere Monate lang beobachtet, insbesondere um die Entwicklung ihrer Antikörper oder der B- und T-Lymphozyten im Blut zu verfolgen. Dieser Schritt ermöglicht es, die Einzelheiten der Immunantwort zu untersuchen, die Verabreichungsschemata (Anzahl der Dosen usw.) festzulegen und häufige Nebenwirkungen zu identifizieren.
- An Phase-III-Studien nehmen mehrere zehn- oder hunderttausend Freiwillige teil. Der Zweck dieser Studien ist es, herauszufinden, ob der Impfstoff vor der Krankheit schützt. Das bedeutet, dass beobachtet wird, inwieweit geimpfte Personen, die dem Krankheitserreger ausgesetzt sind, in den Wochen oder Monaten nach der Impfung gegen die Krankheit resistent sind. Nur in diesen gross angelegten Studien können seltene Nebenwirkungen erkannt werden. Diese Studien beantworten auch die Frage, in welchen Alters- oder Bevölkerungsgruppen der Impfstoffkandidat wirksam ist – oder eben nicht.
- Phase IV-Studien werden nach der Zulassung eines Impfstoffs durchgeführt, um dessen Verwendung in Bevölkerungsgruppen zu klären, die nicht in den vorhergehenden Studien eingeschlossen waren. Sie sollen auch prüfen, ob bei den Millionen von Menschen, die geimpft wurden, sehr seltene, aber schwerwiegende unerwünschte Ereignisse auftreten.
Wer entscheidet, ob ein Impfstoff vermarktet werden kann?
Bevor ein Hersteller einen Impfstoff auf den Markt bringen kann, muss der Impfstoff von den für die Sicherheit von Arzneimitteln zuständigen Aufsichtsbehörden zugelassen werden. Zu diesem Zweck muss der Hersteller bei den Zulassungsbehörden (Swissmedic in der Schweiz, die EMA in Europa, die FDA in den USA und die WHO für die ganze Welt) ein vollständiges Dossier einreichen. Der Hersteller muss auch nachweisen, dass er in der Lage ist, den Impfstoff sicher und in grossem Massstab zu produzieren.
Für die Massenproduktion müssen Labors, die Impfstoffe entwickeln, oft mit einem oder mehreren grossen spezialisierten Pharmaunternehmen zusammenarbeiten, die über die notwendigen technischen Ressourcen verfügen.
Bevor eine Charge des Impfstoffs auf den Markt gebracht wird, muss der Hersteller sie der Zulassungsbehörde zur Genehmigung vorlegen. Die Behörde überwacht die Qualität, die Sicherheit und die Wirkung auf das Immunsystem. Die Zulassungsbehörden sind also dafür verantwortlich, die Sicherheit von Impfstoffen zu analysieren und deren Vertrieb zu genehmigen.
Wer entscheidet, ob, wem und wie ein Impfstoff empfohlen werden soll?
Dieser Schritt liegt in der Verantwortung der für die Impfstoffempfehlungen zuständigen Gesundheitsbehörden (in der Schweiz sind das die Eidgenössische Kommission für Impffragen (EKIF) und das Bundesamt für Gesundheit (BAG)).
Eine Impfung gegen eine Krankheit wird nur dann empfohlen, wenn ihr Nutzen das Risiko unerwünschter Wirkungen bei weitem überwiegt. Diese Entscheidung beruht auf einer systematischen Analyse. Gegen ein und dieselbe Krankheit können mehrere von Swissmedic zugelassene Impfstoffe eingesetzt werden. Die Eidgenössische Kommission für Impffragen kann dann je nach den Merkmalen der Bevölkerung die Verwendung eines Impfstoffs anstelle eines anderen empfehlen. Sie legt fest, wem (aufgrund vom Alter oder aufgrund von Risikofaktoren) der Impfstoff empfohlen wird, wie viele Dosen verabreicht werden sollen, oder ob wegen eines erhöhten Krankheitsrisikos im Land eine Auffrischung erforderlich ist.
Das Bundesamt für Gesundheit ist auch für die Kostenverhandlungen mit den Herstellern des Impfstoffs verantwortlich.
Von der Entwicklung bis zur Vermarktung eines Impfstoffs dauert es im Durchschnitt zehn bis zwanzig Jahre, manchmal sogar länger. Aber im Notfall ist es möglich, diese Dauer zu verkürzen, wie dies im Fall der Ebola-Krankheit oder COVID-19 geschehen ist.

