L'immunosenescenza è un cambiamento progressivo e degenerativo che si verifica nel sistema immunitario con l'avanzare dell'età. Questi cambiamenti possono portare a:
1. Riduzione della funzione immunitaria, che rende le persone anziane più suscettibili alle infezioni o allo sviluppo di forme gravi di infezione.
2. Infiammazione cronica: questa infiammazione persistente può contribuire allo sviluppo di malattie legate all'età, come le malattie cardiovascolari, il diabete di tipo 2 e la demenza.
3. Cambiamento nella composizione delle cellule immunitarie: con una diminuzione del numero di linfociti T naïve (non specializzati) e un aumento del numero di linfociti T delle memoria (specializzati), che può limitare la capacità del sistema immunitario di riconoscere nuovi agenti patogeni.
4. Risposta ridotta ai vaccini: gli anziani possono avere una risposta immunitaria meno robusta dopo la vaccinazione - così come avviene per le persone immunodepresse - un fatto che può richiedere dosi più elevate o richiami aggiuntivi per una protezione adeguata.
Anche il sistema immunitario invecchia
Una delle ragioni di questi cambiamenti è che le cellule staminali del sangue situate nel midollo osseo diventano meno produttive con l'età; in particolare, producono meno globuli bianchi, che sono una componente importante del sistema immunitario. Per questo motivo, ad esempio, il vaccino Shingrix® contro l'herpes zoster è stato formulato con speciali adiuvanti che rafforzano e prolungano la risposta immunitaria. Questo vaccino è indicato per i soggetti più a rischio, ovvero le persone di età pari o superiore a 65 anni o quelle sottoposte a immunosoppressione. Altre opzioni, attualmente in fase di studio, prevedono la somministrazione di dosi più elevate di vaccino, come il vaccino Efluelda® contro l'influenza stagionale, o dosi di richiamo più frequenti a queste persone.
Malattie e trattamenti riducono le difese immunitarie
Oltre all'età, anche varie malattie e i relativi trattamenti possono indebolire il sistema immunitario. Ad esempio, le persone che hanno subito un trapianto d'organo devono assumere farmaci immunosoppressori che impediscono all'organismo di riconoscere l'organo trapiantato come estraneo e di rigettarlo. Questo aumenta la loro vulnerabilità alle infezioni. Per questo motivo le dosi di vaccinazione mancanti dovrebbero essere recuperate, se possibile, prima di effettuare un trapianto.
Il sistema immunitario si indebolisce anche dopo un trapianto di cellule staminali, ad esempio in caso di leucemia: in questo caso, le cellule immunitarie vengono prima uccise e poi sostituite da cellule staminali. Possono essere necessari diversi mesi perché si sviluppi un nuovo sistema di difesa efficace a partire dalle cellule trapiantate. Inoltre, la protezione acquisita durante le vaccinazioni precedenti viene completamente persa e deve essere ricostruita gradualmente.
Anche molte malattie croniche e i farmaci necessari per il loro trattamento hanno un impatto negativo sul sistema immunitario. Per esempio, le persone affette da sclerosi multipla, malattie reumatiche infiammatorie, autoimmuni o da malattie intestinali sono più vulnerabili all'influenza, all'epatite e al papillomavirus umano. Il trattamento di queste malattie con farmaci immunosoppressivi o immunomodulanti, come i corticosteroidi, può rafforzare ulteriormente questo effetto. Anche i tumori e molti trattamenti per queste malattie indeboliscono la risposta immunitaria.
Per le persone immunodepresse, l'UFSP e la Commissione federale per le vaccinazioni (CFV) hanno elaborato linee guida e raccomandazioni volte a garantire la migliore protezione vaccinale possibile con il minor rischio possibile. La somministrazione di vaccini vivi attenuati è generalmente sconsigliata per questa categoria di popolazione, in quanto potrebbe portare alla "malattia vaccinale". Infine, anche i familiari e i contatti stretti possono dare un contributo: vaccinandosi, proteggono le persone immunodepresse limitando il rischio di contaminazione.
Fonti :
Crooke SN, Ovsyannikova IG, Poland GA, Kennedy RB. Immunosenescence and human vaccine immune responses. Immunity & Ageing. 2019;16(1):25.doi:10.1186/s12979-019-0164-9
Doherty M, Schmidt-Ott R, Santos JI, et al. Vaccination of special populations: Protecting the vulnerable. Vaccine. 2016;34(52):6681-6690. doi:10.1016/j.vaccine.2016.11.015
Allen, Toapanta, Chen, Tennant. Understanding immunosenescence and its impact on vaccination of older adults. Vaccine. 2020;38(52): 8264-8272. https://doi.org/10.1016/j.vaccine.2020.11.002
Ciabattini, Annalisa et al. “Vaccination in the elderly: The challenge of immune changes with aging.” Seminars in immunology vol. 40 (2018): 83-94. doi:10.1016/j.smim.2018.10.010
Cosa sono gli adiuvanti e perché sono necessari?
Un adiuvante è una componente importante di molti vaccini inattivati: rafforzano e prolungano la risposta del sistema immunitario. Il termine adiuvante deriva dal verbo latino adjuvare, che significa "aiutare".
I primissimi vaccini, ad esempio contro il vaiolo, non avevano bisogno di adiuvanti: erano composti da virus completi - anche se attenuati - che, senza alcun aiuto, scatenavano una forte risposta immunitaria nell'organismo. Oggi, molti vaccini contengono solo frammenti di agenti patogeni. Se da un lato si evitano effetti collaterali importanti, dall'altro si ha lo svantaggio che la risposta del sistema immunitario è più debole.
Solo una manciata di adiuvanti conosciuti
Una soluzione a questo problema fu scoperta per caso dall'immunologo britannico Alexander Glenny negli anni Venti: egli scoprì che l’aggiunta di piccole quantità di un sale di alluminio insolubile nel vaccino aumentava la risposta immunitaria. Questi sali (idrossidi di alluminio e fosfati di alluminio) - noti anche come "allume" nel linguaggio comune - sono stati i primi adiuvanti e sono ancora oggi un componente di molti vaccini (vedi tabella sotto).
In passato, l'alluminio contenuto nei vaccini era sospettato di causare malattie come il cancro al seno e delle allergie. Oggi si ritiene che tale legame sia da escludere, anche perché le quantità contenute sono estremamente ridotte (vedi anche Alluminio nei vaccini). Tuttavia, dopo la vaccinazione con vaccini contenenti alluminio, possono comparire effetti collaterali temporanei come arrossamento o gonfiore nel sito di iniezione. Si tratta di un segno di attivazione del sistema immunitario.
Per oltre 70 anni, i sali di alluminio sono stati gli unici adiuvanti conosciuti e sono stati utilizzati miliardi di volte. Solo negli ultimi decenni sono state scoperte una manciata di altre sostanze e ne è stato autorizzato l'uso nell'uomo. Queste includono, per esempio, le emulsioni di acqua e olio, contenute nei vaccini antinfluenzali stagionali con il nome di "MF59".
Gli adiuvanti più recenti sono le saponine, sostanze estratte dall'albero della corteccia di sapone. Fanno parte dei vaccini contro l'herpes zoster (Shingrix®) e l'RSV (Arexvy®), raccomandati in Svizzera. Per ottimizzarne l'effetto, è possibile combinare diversi adiuvanti.
La difficile ricerca di nuovi adiuvanti
La ricerca di nuovi adiuvanti non è facile: non solo devono attivare il sistema immunitario, ma devono anche avere pochi effetti collaterali ed essere degradati nell'organismo. Anche la produzione poco costosa e la lunga durata di conservazione sono criteri importanti.
Un altro ostacolo è rappresentato dal fatto che l'esatta modalità d'azione degli adiuvanti non è ancora del tutto chiara. Per molto tempo si è ipotizzato, ad esempio, che l'allume avesse una sorta di effetto deposito e che rilasciasse il vaccino lentamente, in modo che la risposta immunitaria richiedesse più tempo. Oggi è chiaro che i sali di alluminio hanno molti altri effetti: attraverso varie vie di segnalazione, allertano il sistema immunitario e attirano determinate cellule immunitarie. Queste si scontrano poi con frammenti di agenti patogeni, innescando la formazione di un'immunità specifica. Le emulsioni e le saponine sembrano attivare meccanismi simili.
La ricerca sta ancora studiando nuovi tipi di adiuvanti per aumentare l'efficacia dei vaccini inattivati o per rispondere in modo specifico alle esigenze di alcuni gruppi di popolazione, come i bambini o gli anziani.
Non tutti i vaccini richiedono coadiuvanti: i vaccini combinati contro morbillo, orecchioni e rosolia (MOR) contengono agenti patogeni completi e attenuati che non richiedono sostanze aggiuntive. Nel caso dei vaccini a RNA messaggero contro la SARS-CoV-2, le stesse nanoparticelle lipidiche caricate con RNA fungono da adiuvanti.
Esempi di vaccini autorizzati in Svizzera e di coadiuvanti in essi contenuti:
|
Vaccini |
Malattie |
Adivanti |
|
Priorix |
MOR (morbillo, orecchioni e rosolia) |
- |
|
Boostrix |
DTP (difterite, tetano, pertosse) |
Alum |
|
Prevenar |
Pneumocochi |
Alum |
|
Gardasil |
HPV (virus del papilloma umano) |
Alum |
|
Twinrix |
Epatite A/Epatite B |
Alum |
|
Encepur |
FSME (meningoencefalite da zecche) |
Alum |
|
Fluad |
Influenza |
MF59 |
|
SHINGRIX |
Herpes zoster / fuoco di Sant’Antonio |
AS01B |
|
Novavax |
SARS-CoV2 |
Matrix M-1 |
|
Comirnaty |
SARS-CoV2 |
- |
|
Spikevax |
SARS-CoV2 |
- |
Fonti:
C. Reyes et al.: Adjuvants approved for human use: What do we know and what do we need to know for designing good adjuvants? European Journal of Pharmacology (2023)
https://doi.org/10.1016/j.ejphar.2023.175632
B. Pulendran et al.: Emerging concepts in the science of vaccine adjuvants. Nature Review Drug Discovery (2021).
https://doi.org/10.1038/s41573-021-00163-y
J.-D. Masson et al.: Advances on the early cellular events occurring upon exposure of human macrophages to aluminum oxyhydroxide adjuvant. Scientific Reports (2023)
https://doi.org/10.1038/s41598-023-30336-1
K. Kobiyama et al.: Making innate sense of mRNA vaccine adjuvanticity. Nature Immunology (2022)
https://doi.org/10.1038/s41590-022-01168-4
Come si sviluppa un vaccino ?
Un vaccino serve ad addestrare il sistema immunitario a lottare contro un microbo che può causare una malattia grave o addirittura mortale. Il microbo può essere un virus, un batterio o anche un parassita (nel caso della malaria, per esempio). Poche ore dopo una dose di vaccino, i globuli bianchi specializzati del sistema immunitario – i linfociti B e i linfociti T- sono già attivati. E dopo circa 15 giorni, i linfociti B rilasciano nel sangue gli anticorpi specifici che possono legarsi al microbo bersaglio del vaccino. Alcuni anticorpi neutralizzano il microbo per impedirgli di entrare nelle cellule umane. D'altra parte, i linfociti T (chiamati "killer") entrano in gioco per eliminare i microbi in modo che essi non causino malattie o complicazioni.
Affinché il sistema immunitario possa produrre i linfociti B e T efficaci contro un particolare microbo, essi devono imparare a riconoscere alcuni elementi caratteristici di questo microbo: si tratta spesso di proteine specifiche presenti sulla sua superficie. Un vaccino contiene sempre almeno alcuni di questi elementi caratteristici del microbo bersaglio. Questi elementi possono essere presentati al sistema immunitario in diversi modi.
- Vaccini contenenti l'intero microbo in forma attenuata. La forma "attenuata" si ha quando il microbo viene manipolato per renderlo meno aggressivo, ad esempio riducendo la sua capacità di moltiplicarsi. È il metodo più efficace ma anche quello che richiede più cautela. I vaccini vivi attenuati mimano l’immunità naturale e innescano una risposta immunitaria più forte e duratura: dopo 1 o 2 dosi, non richiedono più richiami. Il loro svantaggio principale è che non possono essere somministrati (a parte qualche eccezione) a persone il cui sistema immunitario è indebolito da alcune malattie o trattamenti farmacologici.
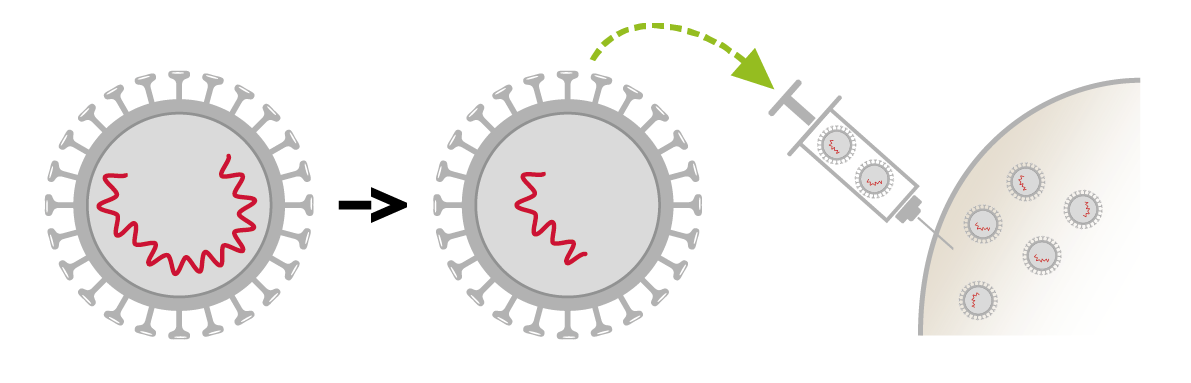
Vaccini vivi attenuati attualmente in uso (MPR : morbillo-orecchioni-rosolia, varicella, herpes zoster, febbre gialla, rotavirus).
- Vaccini contenenti l'intero microbo in forma inattivata. Il microbo viene ucciso ed è totalmente incapace di moltiplicarsi, quindi non può causare malattie I vaccini interi inattivati sono in generale meno efficaci dei vaccini vivi attenuati e spesso richiedono dosi multiple o dosi di richiamo. Il loro vantaggio principale è che hanno pochissimi effetti collaterali e possono essere somministrati anche a persone con un sistema immunitario indebolito.
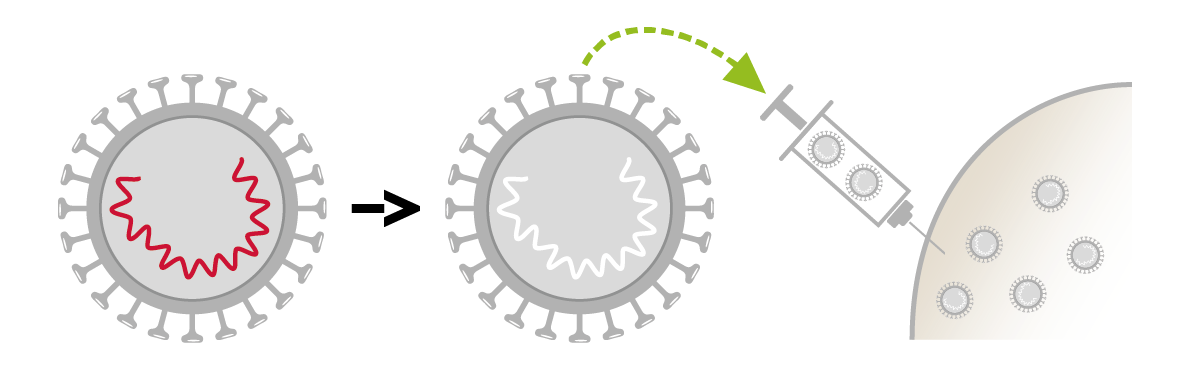
Vaccini interi disattivati attualmente in uso (polio, epatite A, MEVE, meningococchi)
- Vaccini purificati contenenti solo uno o più frammenti del microbo. I vaccini contengono solo quelle parti del microbo che sono necessarie al sistema immunitario per riconoscerlo e per attivare una buona protezione. Questi vaccini hanno il vantaggio di stimolare il sistema immunitario in modo molto mirato. La loro tolleranza è quindi eccellente, ma spesso sono necessari dei richiami. Video esplicativi sui vaccini proteici.
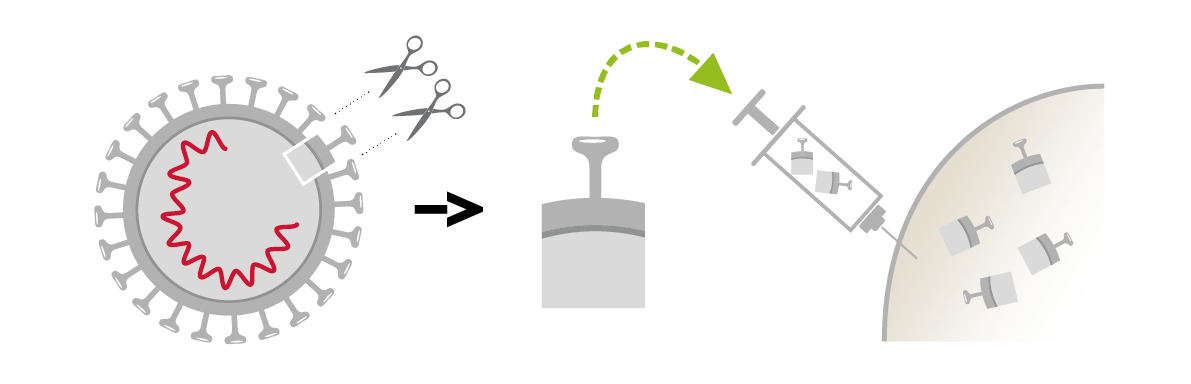
Vaccini purificati (difterite, tetano, pertosse, epatite B, HPV, influenza, etc.)
- Vaccini coniugati, contenenti unicamente zuccheri complessi (polisaccaridi) della capsula del microbo, fissati a una proteina di trasporto per essere meglio riconosciuti dal sistema immunitario. Per ottenere un’immunità occorrono diverse iniezioni e l’immunità dura talvolta solo alcuni anni.
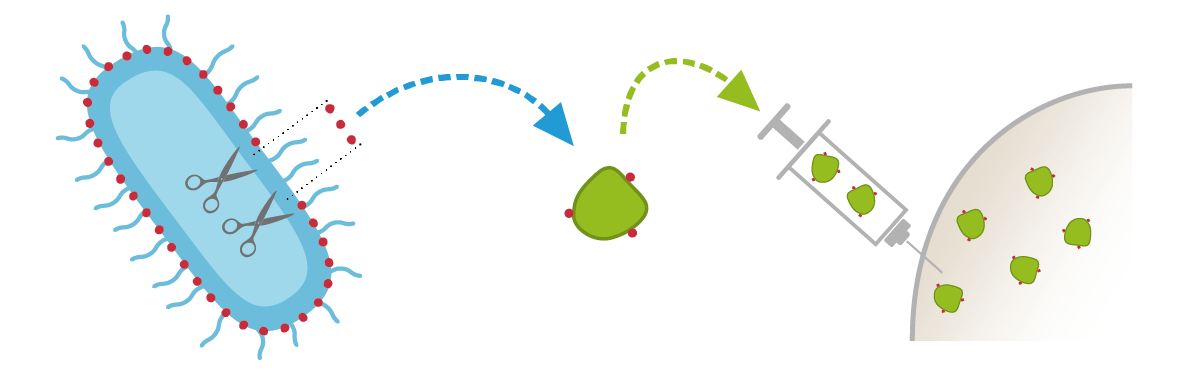
Vaccini coniugati (Hib, pneumococchi)
- Nuove tecniche di progettazione di vaccini, per esempio attraverso l’iniezione di un frammento del materiale genetico (RNA) del microbo, avvolto in una nanoparticula costituta da diversi lipidi. La tecnologia del vaccino messaggero contro l'RNA è nota da circa dieci anni, ma nonostante la sua attratività (semplicità di concetto, velocità di sviluppo e facilità di produzione), non ha beneficiato degli investimenti necessari prima della mobilitazione che ha seguito la pandemia COVID-19.
Confronto tra l'infezione da coronavirus naturale e la vaccinazione con un RNA messaggero (schemi semplificati)
A. Infezione naturale
1. Il coronavirus SARS-CoV-2 entra nel corpo umano e si lega a una cellula grazie alle sue proteine di superficie a forma di chiodo (in inglese, questa proteina è chiamata Spike).
2. Il virus viene assorbito nella cellula dove rilascia il suo RNA (codice genetico che contiene tutte le informazioni necessarie per creare lo stesso virus).
3. La cellula umana utilizza il proprio macchinario biologico per leggere l'RNA virale e fabbricare, suo malgrado, tutte le parti del virus (diversi tipi di proteine + RNA virale).
4. I nuovi virus sono in grado di auto-assemblarsi e poi, una volta rilasciati nel corpo umano, possono proseguire la loro azione, contaminando nuove cellule.
Per impedire al virus di replicarsi bisogna attendere che il sistema immunitario dell'organismo reagisca e produca anticorpi. Questo processo richiede diversi giorni.
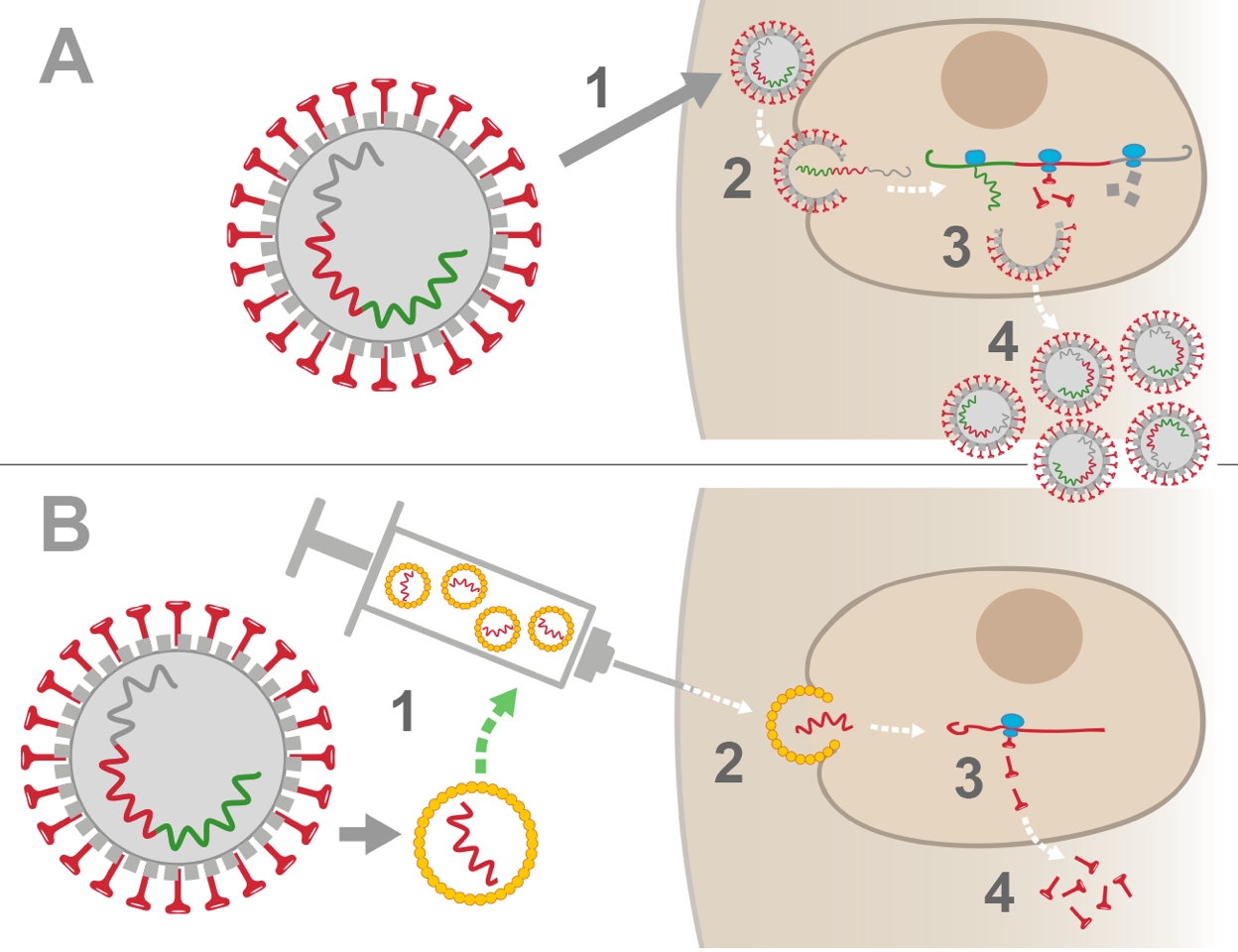
B. Vaccinazione con RNA messaggero virale
1. In laboratorio, si fabbricano degli RNA messaggeri in grado di produrre unicamente la proteina Spike del coronavirus. Gli RNA messaggeri sono inseriti in piccole sfere di grasso.
2. Durante la vaccinazione, le sfere di grasso vengono iniettate nel muscolo del braccio e poi assorbite dalle cellule muscolari umane: all’interno della cellula gli RNA messaggeri vengono rilasciati.
3. La cellula umana utilizza il proprio macchinario biologico per leggere l'RNA messaggero e produrre unicamente le proteine Spike. Queste proteine, da sole, non sono pericolose per l’organismo.
4. La cellula rilascia le proteine virali Spike nel corpo. Il sistema immunitario sarà allertato dalla presenza di queste proteine e permetterà all’organismo di produrre anticorpi contro la proteina Spike.
2-3 settimane dopo la vaccinazione, se un coronavirus entra nell'organismo, il sistema immunitario lo riconosce rapidamente e lo neutralizza, utilizzando gli anticorpi contro la proteina Spike prodotti precedentemente in seguito alla vaccinazione.
6. Vaccini «con vettore»: un frammento importato dal microbo è inserito in un virus o un batterio che non provocano malattie nell’essere umano.. Questi "vettori" sono scelti in modo che la loro moltiplicazione sia limitata nel corpo umano, senza causare infezioni, ma capaci comunque di stimolare una risposta immunitaria. Si tratta di una tecnica recente ma che ha dato prova di essere utile nella vaccinazione contro la malattia di Ebola e contro alcuni tumori. Nel caso dei vaccini vettoriali virali a base di adenovirus contro il Covid-19 (vaccini Astra Zeneca/Università di Oxford e Janssen/Johnson&Johnson), il codice genetico degli adenovirus è modificato (DNA troncato) in modo che il virus non possa replicarsi nel corpo umano. È quindi biologicamente escluso che possa causare un'infezione da adenovirus modificato. Il DNA di questi adenovirus usati come vettori può entrare nei nuclei delle cellule, ma l'incorporazione nel DNA delle cellule umane è impedita dalla modifica delle estremità del suo filamento di DNA. Il DNA di questi adenovirus viene trascritto in RNA messaggero nel nucleo e poi espulso nel citoplasma dove viene tradotto in proteine. 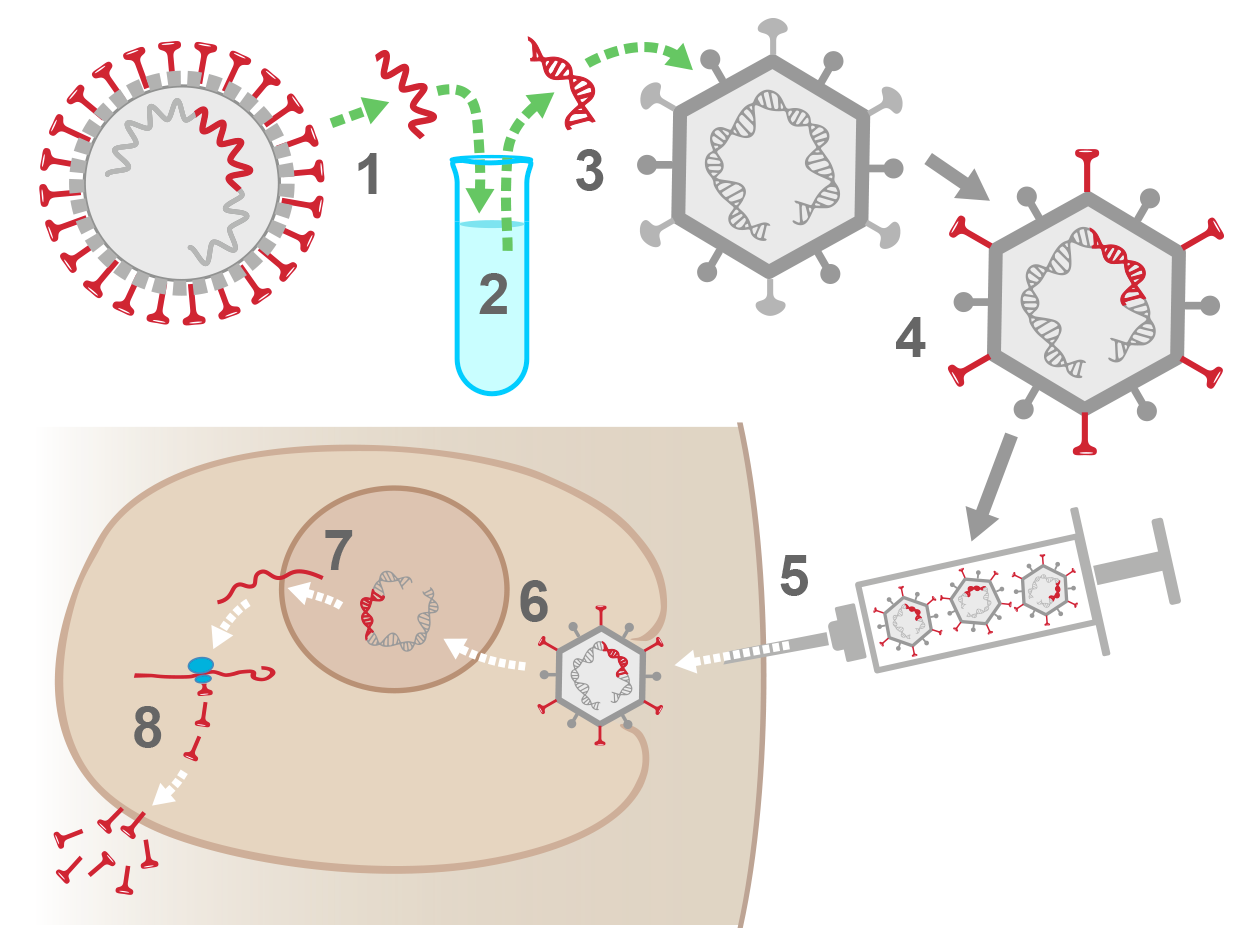
1. In laboratorio, si estrae la sequenza di RNA del coronavirus che contiene le informazioni per costruire la sua proteina di superficie Spike (in rosso).
2. La sequenza RNA-Spike viene convertita in una sequenza DNA-Spike.
3. La sequenza DNA-Spike è inserita nel cromosoma di un adenovirus.
4. L'adenovirus modificato porta la proteina di superficie Spike sulla sua superficie, ma non è in grado di moltiplicarsi.
5. Vaccinazione: l'adenovirus modificato viene iniettato nel braccio di una persona.
6. L'adenovirus modificato entra in una cellula umana e trasferisce il suo DNA nel nucleo della cellula. Il DNA del vaccino è modificato in modo da non integrarsi nel genoma.
7. Nel nucleo, la sequenza DNA-Spike viene trascritta in RNA messaggero che poi esce dal nucleo.
8. I dispositivi biologici della cellula umana leggono gli RNA messaggeri, producono le proteine Spike e le rilasciano nel corpo - questo avviserà il sistema immunitario e permetterà all’organismo di produrre anticorpi contro la proteina Spike.
2-3 settimane dopo la vaccinazione, se un coronavirus entra nel corpo, il sistema immunitario sarà in grado di riconoscerlo rapidamente e neutralizzarlo, in particolare con l'aiuto di anticorpi contro la proteina Spike.
Video esplicativi (Swissmedic) sui vaccini vettoriali.
Quali sono le diverse tappe che i possibili candidati vaccini devono affrontare prima di poter essere utilizzati ?
Una volta che un candidato vaccino è stato sviluppato (vedi sopra), deve passare attraverso diverse fasi di sviluppo.
I test preclinici (su animali) sono di solito effettuati sui roditori e poi sulle scimmie. Questo è un passo essenziale per selezionare i migliori candidati ed evitare di somministrare all'uomo vaccini inefficaci o troppo infiammatori. Queste prove possono spesso dare risultati eccellenti negli animali, ma non necessariamente nell'uomo.
Gli studi clinici (nell'uomo) sono condotti in quattro fasi:
- Gli studi di Fase I di solito coinvolgono qualche dozzina di volontari. Sono progettati per osservare possibili effetti collaterali molto comuni (rispetto a un placebo o a un vaccino noto). Essi aiutano anche a determinare la migliore dose di vaccino sperimentale misurando gli anticorpi prodotti dai volontari.
- Gli studi di Fase II ampliano la base di conoscenze includendo diverse centinaia o migliaia di volontari in diversi centri clinici. I volontari vengono seguiti per diversi mesi, in particolare per monitorare l'evoluzione dei loro anticorpi o dei livelli di linfociti B e T nel sangue. Questa fase permette di studiare i dettagli della risposta immunitaria, di specificare i regimi di somministrazione (numero di dosi, ecc.) e di identificare gli effetti collaterali frequenti.
- Gli studi di Fase III coinvolgono diverse decine o centinaia di migliaia di volontari. Il loro scopo è quello di scoprire se il vaccino protegge dalla malattia. Ciò significa osservare in che misura le persone vaccinate, che sono e state sposte al microbo, sono resistenti alla malattia nelle settimane/mesi dopo la vaccinazione. Questi studi su larga scala sono gli unici in grado di rilevare rari effetti collaterali, oltre a definire in quali gruppi di età o gruppi di popolazione il candidato vaccino è efficace - o meno.
- Gli studi di Fase IV sono condotti dopo la commercializzazione di un vaccino per chiarirne l'uso in popolazioni che non sono state incluse negli studi di fase II e III. Sono anche progettati per verificare se si osservano venti avversi, molto rari ma gravi, tra le milioni di persone che sono state vaccinate.
Chi decide se un vaccino può essere commercializzato ?
Per essere immesso sul mercato, un vaccino deve ricevere l’autorizzazione dalle autorità di regolamentazione responsabili della sicurezza dei prodotti farmaceutici. Il produttore deve presentare un dossier completo alle autorità di regolamentazione (Swissmedic in Svizzera, l'EMA in Europa, la FDA negli USA e l'OMS per tutto il mondo). Il produttore deve anche dimostrare di essere in grado di produrlo in modo sicuro e su larga scala.
Affinché un vaccino possa essere prodotto in serie, i laboratori che sviluppano i vaccini devono spesso collaborare con una o più grandi aziende farmaceutiche specializzate che dispongono delle risorse tecniche necessarie.
Prima che un lotto del vaccino venga immesso sul mercato, il produttore deve presentarlo per l'approvazione all'autorità di regolamentazione che ne controlla la qualità, la sicurezza e gli effetti sul sistema immunitario. Pertanto, le autorità di regolamentazione sono responsabili dell'analisi della sicurezza dei vaccini e dell'autorizzazione alla loro immissione sul mercato.
Chi decide se un vaccino deve essere consigliato, a chi e come ?
Questo passo spetta alle autorità sanitarie competenti per le raccomandazioni sui vaccini (in Svizzera, la Commissione federale dei vaccini e l'Ufficio federale della sanità pubblica (UFSP)).
La vaccinazione contro una malattia è raccomandata solo se il suo beneficio supera di gran lunga il rischio di provocare effetti negativi. La decisione si basa su un quadro analitico. Contro la stessa malattia possono essere utilizzati più vaccini approvati da Swissmedic. La Commissione federale per le vaccinazioni può quindi raccomandare l'uso di un vaccino piuttosto che di un altro, a seconda delle caratteristiche della popolazione. Essa determina a chi (età, fattori di rischio) si raccomanda il vaccino, quante dosi e con quale frequenza deve essere somministrato, quando è necessario un richiamo a seconda del rischio di malattia nel paese, ecc.
Le autorità sanitarie (UFSP) sono inoltre responsabili della negoziazione dei costi del vaccino con i produttori.
Tutte queste fasi - dallo sviluppo alla commercializzazione di un vaccino - richiedono in media dai 10 ai 20 anni, a volte anche di più. Ma quando c'è un'emergenza, è possibile accorciare queste fasi, come è stato fatto nel caso della malattia di Ebola o contro il Covid-19.

